AshrafizadehM,ZarrabiA,Karimi-MalehH,TaheriazamA,MirzaeiS,HashemiM,HushmandiK,MakvandiP,NazarzadehZareE,SharifiE,GoelA,WangL,RenJ,NuriErtasY,KumarAP,WangY,RabieeN,SethiG,MaZ.(Nano)platformsinbladdercancertherapy:;8(1)::10.1002/:36684065;PMCID:PMC9842064.
一、简介泌尿系统癌症是全世界高死亡率的原因,而膀胱癌是泌尿系统中最常见的肿瘤。膀胱癌有两种主要形式,包括肌层浸润性膀胱癌(MIBC)和非肌层浸润性膀胱癌(NMIBC)。NMIBC的转移发生率很少见,尽管经尿道切除术后复发的几率为50%–70%。1大约10%–20%的病例是MIBC,某些MIBC患者的转移风险很高,这导致近30%的患者生存期短。2,3在根治性膀胱切除术后,一些MIBC患者表现出淋巴转移,可导致诊断后5年内死亡。4个大多数膀胱癌病例发生在男性身上。在美国,这些患者的人数估计为83,730人。5,6在中老年男性中,膀胱癌是第二常见的恶性肿瘤。7膀胱癌的发生和发展有多种风险因素,包括吸烟、年龄、家族史、接触化学品和染料以及慢性膀胱炎症。8NMIBC患者预后良好,通过局部治疗,可阻止NMIBC向MIBC的转化,及时治疗可抑制肿瘤复发。由于转移的发展,MIBC患者的预后不利,除切除术外,患者还接受辅助化疗。9然而,治疗似乎并不完全有效,尽管积极治疗,患者仍出现转移。10除手术和化学疗法外,在某些情况下还可以采用放射疗法和免疫疗法来治疗膀胱癌。11,12膀胱癌还有一种根据肿瘤发展方式的分类,包括鳞状细胞癌和膀胱粘液分泌细胞癌,这确实很少见。13尽管膀胱癌的治疗策略多种多样,但肿瘤细胞具有对治疗产生耐药性的能力。14,15因此,应遵循治疗膀胱癌的新方法。此外,不同的诊断工具包括磁共振成像(MRI)、计算机断层扫描(CT)和胸部X光等,可用于膀胱癌检测。然而,它们也有其缺点,例如特异性低和膀胱肿瘤细胞的异质性。16
根治性膀胱切除术是膀胱癌治疗的金标准。尽管肿瘤细胞是恶性的,但膀胱癌患者的5年生存率估计为20%至40%。17,18为了提高膀胱癌治疗的潜力,推荐使用甲氨蝶呤、长春碱、多柔比星和顺铂进行联合治疗。19然而,在接受根治性膀胱切除术的高危患者中,顺铂和吉西他滨联合治疗膀胱癌和提高总体生存率并不显着。19据估计,据报道只有50%的膀胱癌患者对顺铂介导的化疗有反应。20与其他方案相比,顺铂和吉西他滨的组合在治疗膀胱癌和延缓转移方面表现出低副作用和高潜力。21,22除化疗和根治性膀胱切除术外,盆腔淋巴结清扫术也用于治疗膀胱癌。23,24对于接受手术的患者,放疗也被用作一种治疗方式,与化疗相结合,可以提高治疗效果。25尽管放疗和化疗以及手术在膀胱癌治疗中的应用做出了巨大努力,但由于肿瘤细胞的不良影响、耐药性发展和转移性,仍然存在挑战。膀胱肿瘤细胞的转移限制了手术在膀胱癌治疗中的应用。放射疗法和化学疗法都对主要器官表现出明显的副作用。放疗和化疗在抑制膀胱癌方面的潜力受到耐药性发展的限制。21,26,27膀胱癌的新兴治疗方法之一是免疫疗法的应用。近年来,针对膀胱癌开发了多种检查点抑制剂,包括PD-L1/PD1、CTLA-4以及CART细胞疗法。然而,免疫逃避降低了膀胱癌免疫治疗的潜力。28纳米技术是一个跨学科领域,它为传染病和癌症等各种疾病的治疗和诊断开辟了道路。29,30,31,32,33,34,35,36,37,38,39纳米结构的尺寸在nm范围内,因此它们很容易被肿瘤细胞内化。纳米结构可用于货物(药物和基因)递送、免疫治疗、光疗和诊断。本综述的目的是全面讨论纳米材料在膀胱癌治疗和诊断中的应用。
去:
2.化疗药物输送中的纳米平台癌症治疗中的最佳治疗方法之一是化疗药物的应用。静脉注射是这些抗癌药物给药的主要途径。但全身毒性主要伴随化疗药物的应用,建议少量使用。无论化学治疗剂的不利影响如何,这些药物的频繁应用都会导致耐药性的出现。因此,应该提供这些问题的解决方案。第一步应采用低浓度化疗药物,第二步应联合治疗并增加肿瘤部位的药物蓄积,以防止耐药。40,41,42本节重点介绍用于在膀胱癌治疗中递送化疗药物的纳米级递送系统。
在用于治疗膀胱癌的各种化疗药物中,多柔比星(DOX)是最知名的药物,它能够通过与拓扑异构酶结合来抑制DNA复制和癌细胞增殖来抑制肿瘤进展。43,44,45用聚多巴胺和肽修饰的介孔二氧化硅纳米粒子(MSN)已用于递送DOX。MSN的聚多巴胺修饰对于提供DOX的持续释放及其pH敏感释放很重要,而肽通过与受体结合提供对膀胱肿瘤细胞的特异性靶向。载药MSN的粒径为170.2nm,zeta电位为-15.9mV,载药量为16.25%。这些纳米颗粒在膀胱肿瘤细胞中表现出高内化能力,并且它们提高了DOX在体内膀胱肿瘤抑制中的效力。46一个有趣的观点是,在使用纳米结构封装DOX后,DOX增加了对膀胱肿瘤的抗癌活性并减少了不利影响。47
基于脂质的纳米结构也是膀胱癌中DOX递送的有希望的候选者。阳离子胶束由1,2-二油酰基-3-三甲基铵丙烷/甲氧基聚(乙二醇)(DPP)制备,用于DOX递送,所得纳米载体的大小为18.65nm,zeta电位为+19.6mV。DOX在膀胱肿瘤细胞中的细胞摄取和积累显着增强,并且这些纳米颗粒促进了DOX在膀胱中的停留。体内实验揭示了DOX对膀胱肿瘤的增强抗癌活性。48岁除胶束外,其他种类的脂质纳米结构(称为脂质体)也可用于DOX递送。第一步,制备叶酸修饰的热敏脂质体,然后将DOX、金纳米棒和磁性纳米粒子加载到这些脂质体中。该纳米复合物的粒径为230nm,具有超顺磁性,能够加载0.57mg/ml的DOX。光热影响和温度变化会影响DOX从这些脂质体纳米颗粒中的释放。辐照后,95%的DOX在3小时内释放,由于叶酸修饰,纳米结构与膀胱癌细胞表面的叶酸受体结合,导致其内化增加。49
纳米金刚石(ND)是一种固体纳米结构,由于其高表面积和高载药效率,被认为是药物输送和生物医学应用的理想候选者。50,51,52ND的可用性因其逆转化学耐药性的能力而为癌症治疗打开了一个新窗口。52、53然而,ND的稳定性是一个棘手的问题,限制了它们在货物运输中的潜力。54,55据报道,用聚合物涂覆ND是提高其稳定性的有前途的策略。合成了壳聚糖修饰的ND,用于在膀胱癌治疗中膀胱内递送DOX。这些纳米结构显示出高载药效率(超过90%),平均粒径为150nm。壳聚糖修饰的ND具有很好的胶体稳定性和理想的药物释放,但它们在培养基中的稳定性相对较低。这些载有DOX的壳聚糖修饰的ND在体外显着抑制膀胱肿瘤进展并提供高药物保留。56事实上,DOX的纳米级递送的最终目标是改善和延长其在膀胱肿瘤部位的保留,以将肿瘤细胞活力降低至99%。57
膀胱癌化疗的另一种选择是顺铂(CP),通常用于局部晚期或转移性肿瘤。22然而,临床试验表明使用CP进行膀胱癌化疗具有局限性,为了克服这些缺点,建议将CP膀胱内给药。载有CP的纳米结构已显示出在临床试验中治疗膀胱癌和减少CP的不利影响的潜力。58,59,60,61,62,63,64,65用PEG涂覆纳米材料可增强CP的局部递送并提高动物模型的存活率。66在努力中,CP与poly(l-天冬氨酸钠盐)(PAA)或甲氧基-聚(乙二醇)-嵌段-PAA(PEG-PAA)聚合物,具有低或高PEG含量。这些纳米粒子的膀胱内给药显着减少了CP的副作用并提高了其安全性。值得一提的是,CP的给药与膀胱组织的增生和超重相关,而载有CP的纳米载体表现出高生物相容性且没有此类缺点。负载CP的纳米载体的粒径为140nm,zeta电位为-3.3mV,载药量高达40%。这些纳米粒子对膀胱癌表现出很强的抗增殖活性。值得注意的是,负载CP的PAA修饰的纳米结构增加了膀胱组织中的CP浓度,而PEG修饰的纳米颗粒没有影响。67
有趣的是,纳米载体可以为化疗药物的联合递送提供平台。几项实验表明,合成药物与纳米结构的共同递送在膀胱癌中提供了协同治疗。壳聚糖-聚甲基丙烯酸(CM)纳米胶囊具有附着于膀胱组织腔表面的能力,并且对尿路上皮无损伤,具有很高的生物相容性和安全性。这些纳米胶囊是通过壳聚糖和甲基丙烯酸(MAA)链之间的静电相互作用制备的。然后,将作为抗癌剂的CP和DOX负载到这些纳米颗粒上。与单独使用CP或DOX相比,这种组合的抗癌活性提高了5到16倍,并且它们可以高效地内化到膀胱肿瘤细胞中。73通常,用于合成药物联合递送的纳米颗粒具有很高的包封效率(70%或更高),唯一的限制是由于联合加载导致粒径增加,因此需要了解如何增强粒径会影响纳米载体在膀胱癌细胞中的内化。74,75
之前的讨论揭示了合成药物的纳米级递送系统在提高其抗癌活性方面的作用。值得注意的是,纳米粒子还可以提高膀胱癌治疗中植物化学物质的生物利用度和治疗指数。天然产物具有低成本、多靶点能力和高安全性等优点,使其成为癌症治疗的合适选择。76,77然而,膀胱肿瘤细胞中天然产物的积累很低,这促使科学家们寻找新的递送方法。采用沉淀技术制备了基于PLA的纳米结构,并加载了配糖生物碱提取物(AE)。纳米粒子的粒径为200nm,zeta电位为-12和-7mV,封装效率为85%–90%。这些载有AE的纳米结构以浓度依赖性方式抑制膀胱癌进展,并刺激细胞凋亡和细胞周期停滞。78在另一项实验中,纳米乳液由非离子表面活性剂和印楝籽油合成,然后将白藜芦醇作为植物化学物质加载到这些纳米结构中。纳米颗粒的粒径为137.8nm,并且它们至少稳定30天。它们增加了膀胱癌细胞中白藜芦醇的积累,并显着降低了肿瘤细胞的存活率和活力。79这些研究强调了这样一个事实,即递送具有纳米结构的植物化学物质对于提高它们诱导细胞死亡的能力非常重要,这有利于膀胱癌的治疗(图1个).80,81,82然而,关于受植物化学物质负载的纳米结构影响的分子途径、它们的内化途径以及智能和其他类型纳米颗粒的开发的更多研究是至关重要的。与纳米结构相关的优点是在加载化学治疗剂后评估粒径、zeta电位和封装效率。载药纳米载体表现出低粒径(平均小于150nm)、高稳定性和良好的包封效率,这对于膀胱癌治疗中化疗药物的递送具有重要意义。它们的局限性在于缺乏用于膀胱癌药物递送的碳基和金属基纳米结构,而大多数研究都集中在脂质和聚合物基纳米结构上。此外,
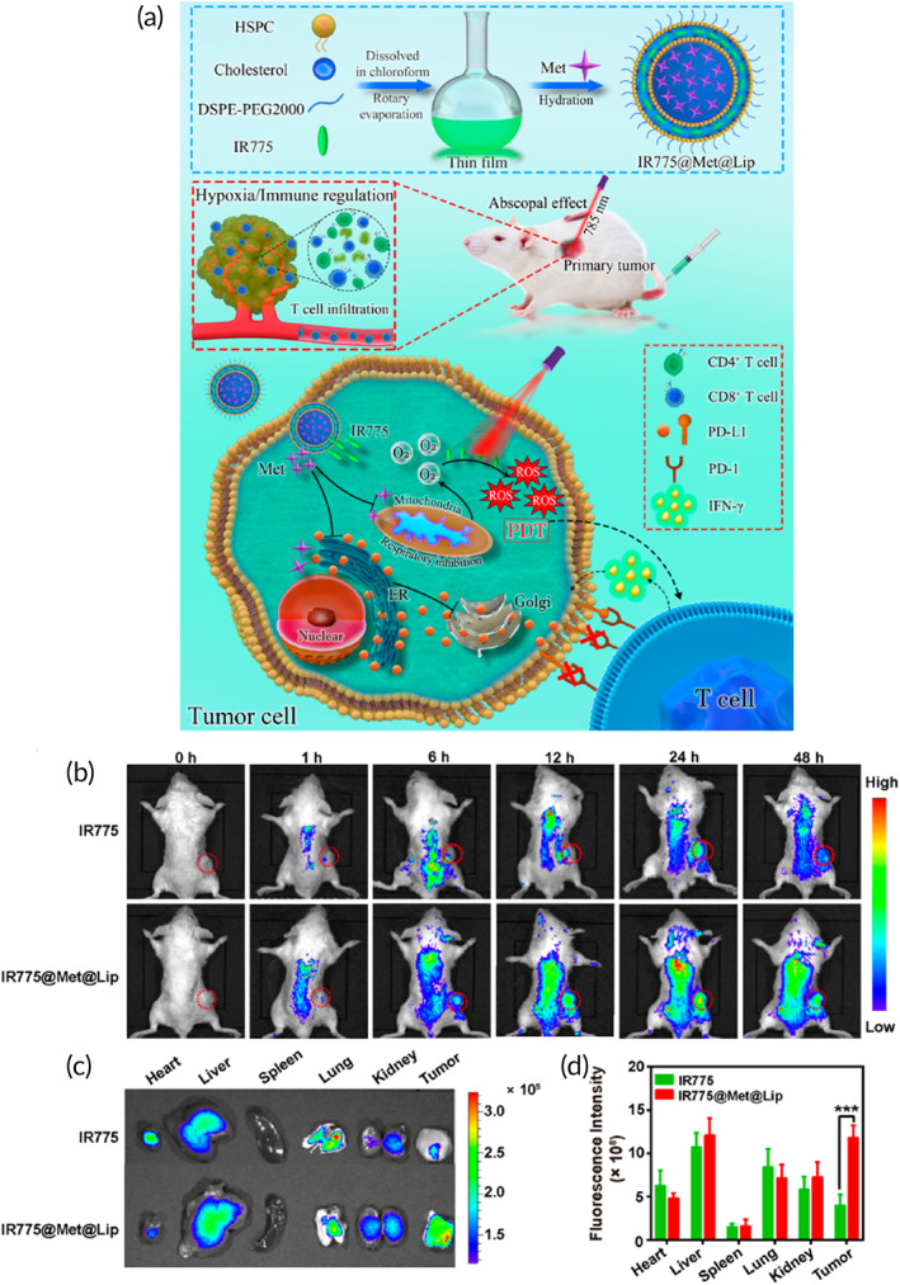
图1
用于在膀胱癌中递送化学治疗剂的纳米材料。阳离子胶束、介孔二氧化硅纳米颗粒、脂质体和壳聚糖纳米颗粒等可用于在癌症治疗中递送药物,例如顺铂,以诱导DNA损伤和细胞凋亡并抑制肿瘤细胞的增殖。DOX,多柔比星;PAA,聚(l-天冬氨酸钠盐);PEG,聚乙二醇
去:
3.基因递送中的纳米平台近年来,很多注意力都集中在基因疗法在疾病,尤其是癌症中的应用。83与针对特定分子通路的药物相比,基因具有更高的特异性,因此,它们在精准医学中非常重要。43迄今为止,各种基因治疗方法已用于癌症治疗。第一种基因模式是应用RNA干扰(RNAi)来降低基因的表达水平。siRNA和shRNA是用于治疗癌症的两种工具,通过沉默靶基因,根据基因的功能,这些工具显着抑制癌症的增殖和侵袭。值得注意的是,siRNA和shRNA有利于逆转肿瘤细胞的耐药性。44,84,85,86,87因此,它们在癌症治疗中的应用可以为癌症患者更好的预后铺平道路。另一种基因治疗方法是靶向非编码RNA(ncRNA)。这些RNA分子不会转化为蛋白质,它们参与进化机制和生物事件(如增殖、迁移和分化)的调节。88,89,90microRNA(miR)是最著名的ncRNA成员,它们参与病理事件。miRNA的异常表达与癌症的发展有关,并且已经在调节它们的表达水平方面做出了重大努力。91虽然基因治疗打开了肿瘤治疗的新大门,但这种方法也面临着自身需要克服的问题。基因治疗的主要障碍是肿瘤组织内核酸药物的低积累。例如,血脑屏障(BBB)阻止药物进入大脑,遗传工具在治疗脑肿瘤方面效果不佳。此外,血肿瘤屏障(BTB)的存在阻碍了核酸药物向肿瘤细胞的内化。体外研究证明了遗传工具的高效性,尽管这些基因在体内的应用会导致它们在血液循环中被RNase酶降解。因此,核酸药物的包封不仅促进了它们在肿瘤组织中的细胞内积累,44,45,85,86,87因此,本节重点介绍纳米材料在膀胱癌治疗中的基因传递应用。
壳聚糖-透明质酸二醛(HAD)纳米结构可以将Bcl-2-siRNA递送至膀胱癌部位并抑制肿瘤生长。使用乙醇-水混合物制备HAD,并将其与壳聚糖纳米结构结合。然后,这些纳米颗粒将siRNA选择性地递送至过表达CD44的膀胱癌细胞。载有siRNA的纳米颗粒的粒径为100-120nm,siRNA的载入效率为95%。它们具有很高的生物相容性和稳定性,通过与膀胱癌细胞表面的CD44受体结合,选择性靶向肿瘤细胞。通过增加siRNA在膀胱癌细胞中的内化,纳米结构降低了Bcl-2的表达,从而抑制了肿瘤细胞的活力。92负责膀胱肿瘤细胞存活的另一个因素是存活蛋白。可生物降解的PLGA纳米粒子被壳聚糖修饰为带正电荷的多糖,以提供它们与带负电荷的siRNA的络合。与未修饰的纳米结构相比,壳聚糖修饰的PLGA纳米颗粒在膀胱肿瘤细胞的内化作用方面增加了10倍。这些纳米结构增加了siRNA的生物活性长达9天,并降低了膀胱癌细胞的生长速度。体内实验证明存活蛋白表达水平降低75%,肿瘤生长减少。93
除miRNA外,环状RNA(circRNA)的水平在膀胱癌中似乎也不正常。例如,circPRMT5在膀胱癌中表现出上调以提高增殖率。值得注意的是,siRNA可用于在膀胱癌治疗中靶向circRPMT5。在一项努力中,制备了外径为25nm、长度为100-200nm的受地球启发的合成温石棉纳米管(SCNT)。这些纳米粒子显着增加了膀胱肿瘤细胞对circPRMT5-siRNA的内化,并通过增加siRNA的半衰期,它们有利于提高siRNA在基因沉默中的潜力。纳米颗粒表现出高安全性并抑制膀胱癌细胞的增殖和侵袭。94
基于这些发现,siRNA的应用对于抑制膀胱癌细胞的增殖和转移具有重要意义,并且它们在基因沉默中的效率增强了使用纳米颗粒进行靶向递送。98、99正如引言部分所提到的,化疗耐药性是膀胱癌中日益严峻的挑战,克服耐药性需要确定参与该过程的因素及其靶向。100Nrf2是一种氧化应激调节剂,通过增强抗氧化防御系统参与降低ROS水平。Nrf2蛋白的过表达有利于保护正常细胞;然而,它的上调会诱导肿瘤细胞对抗癌剂的细胞毒性作用产生抗性。45因此,下调Nrf2是癌症治疗的理想策略。为此,使用胍封端的碳硅烷树枝状大分子(GCD)来递送Nrf2-siRNA以抑制膀胱癌的顺铂耐药性。纳米载体具有各种粒径,例如346.8、128.1和325.6nm,zeta电位为-12.10、2.72和10.34mV。纳米载体具有高生物相容性,确保其进一步应用于膀胱癌的临床试验和治疗。这些纳米载体可显着降低Nrf2的表达水平,从而诱导膀胱癌细胞凋亡和氧化应激,从而显着降低增殖和侵袭能力。此外,载有Nrf2-siRNA的GCD提高了膀胱癌细胞对顺铂化疗的敏感性。101因此,膀胱癌细胞的各个方面,包括生长、转移和治疗反应,都受到载有siRNA的纳米载体的严格调控。
KDM6A是负责调节膀胱肿瘤细胞进展的因子。膀胱癌中的KDM6A突变与肿瘤细胞的免疫逃逸有关,并减少免疫细胞的浸润。102KDM6A与膀胱癌侵袭之间存在密切关联。在分子水平上,KDM6A通过促进ARHGDIB的表达水平下调Rac1来抑制膀胱癌细胞的转移。103一项实验的重点是在膀胱癌治疗中通过粘膜粘附纳米结构递送KDM6A-mRNA。纳米结构的使用能够增强KDM6A-mRNA对膀胱癌部位的暴露并提供持续递送。通过促进KDM6A表达,膀胱肿瘤细胞的转移显着减少。此外,载有mRNA的纳米结构显示出与其他临床批准药物的协同作用。104
除了RNAi和非编码RNA,研究还集中在CRISPR/Cas系统作为一种强大的遗传工具在膀胱癌治疗中的应用。CRISPR/Cas系统有利于膀胱癌细胞进展相关因子的鉴定和治疗靶向。例如,使用CRISPR系统的全基因组筛选证明了MSH2过表达在引发膀胱癌顺铂耐药中的作用。105CRISPR/Cas9和Cas13是用于治疗膀胱癌的最常见类型的CRISPR系统。CRISPR系统可以降低SMAD7e和CacyBP的表达水平,从而抑制膀胱癌细胞的进展。52,106,107,108、109迄今为止,只有一项实验在膀胱癌治疗中使用CRISPR/Cas13a纳米级递送系统。采用水化法合成脂质体,然后加载CRISPR/Cas13a以靶向在膀胱肿瘤细胞中表现出上调的hVEGFR2。纳米结构的粒径为855nm,zeta电位为25.7mV。该递送系统有效下调EGFP基因的表达水平以抑制膀胱肿瘤细胞的进展。110
尽管在将纳米结构应用于膀胱癌基因治疗方面的研究取得了可喜的成果,但仍存在一些问题和局限性。首先是金属和碳基纳米载体尚未用于膀胱癌的基因传递。大多数研究都集中在聚合物纳米颗粒上。另一个限制是大多数研究都涉及siRNA递送。然而,miRNA、shRNA和CRISPR/Cas9系统在膀胱癌治疗中的传递在某种程度上被忽视了,应该进行更多的研究来证明它们的靶向传递如何增强它们的抗癌活性。由于基因带负电荷,因此它们与带正电荷的纳米载体进行稳定的络合。因此,除了壳聚糖,在与膀胱癌治疗中的基因络合方面,研究了其他种类的带正电荷的聚合物。数字2个提供了用于膀胱肿瘤治疗中基因传递的纳米载体的总结。
图2
用于膀胱癌基因传递的纳米材料。siRNA是用于膀胱癌治疗的最著名的载入纳米颗粒的基因。miRNA也可用于膀胱癌治疗,最终目的是诱导细胞凋亡和抑制增殖。PLGA,聚d,l-乳酸-乙醇酸共聚物;PLK-1,polo样激酶1;siRNA,小干扰RNA
去:
4.联合交付中的纳米平台遗传工具的传递促进了它们在基因表达调控方面的功效,而抗癌剂的传递增加了它们的肿瘤抑制活性。包括聚合物基、脂质基、金属基和碳基纳米材料在内的各种纳米结构已被用于共同递送基因和药物,以对抑制癌症进展发挥协同作用。85类似的现象也适用于膀胱癌。用癌细胞膜修饰碳酸钙(CC)纳米结构,然后加载miRNA-451和阿霉素。所得纳米载体的粒径为100nm,可有效抑制膀胱癌的进展。通过递送miRNA-451,纳米载体显着降低P-gp的表达水平,以防止药物外流并增加阿霉素在膀胱癌细胞中的内化,从而在体外和体内抑制肿瘤。111然而,只有一项实验评估了纳米平台在膀胱癌中共同递送基因和药物的潜力。因此,需要更多的证据来证明miRNA与其他抗癌药物如CP和PTX的组合如何提高它们在膀胱癌治疗中的疗效。此外,由于siRNA是抑制膀胱癌的有益中流砥柱,112、113、114、115研究有必要展示siRNA和药物联合递送与癌症治疗的结合。此外,由于遗传工具带有负电荷,而抗癌药物可以是亲水性或疏水性的,因此实验应该表明用各种聚合物修饰纳米粒子如何导致形成稳定的复合物以共同递送基因和药物(表1个).
表格1用于在膀胱癌治疗中递送化学治疗剂的纳米平台
纳米载具粒径(nm)、Zeta电位(mV)货物评论参考介孔二氧化硅纳米粒子170.2纳米,-15.9毫伏阿霉素由于肽修饰和与膀胱肿瘤细胞表面受体的结合,细胞摄取增加
在体外和体内抑制肿瘤生长
46介孔二氧化硅纳米粒子75.5纳米,+33.5毫伏阿霉素纳米粒子与硫醇的功能化增强了它们的粘膜粘附特性
药物释放时间延长
116聚(酰氨基胺)修饰的介孔二氧化硅纳米粒子119.4、127.7和124.5纳米阿霉素封装效率高达95.5%
高粘膜粘附活性
DOX的延长和pH响应释放
117RGD-Fe3O4/CaP/Alg纳米粒子200纳米,-22.9毫伏阿霉素高生物相容性和易于表面功能化
高细胞摄取、pH敏感的药物释放和提高化疗对膀胱肿瘤抑制的疗效
118PAMAM树枝状聚合物纳米粒子13纳米,+2.78毫伏阿霉素高安全性和低粒径
肿瘤部位DOX积累增加
减少DOX对正常细胞的不利影响
在动物模型中抑制肿瘤生长
119rHDL/AD-32纳米颗粒18和20纳米缬柔比星降低细胞毒性药物的IC50值
膀胱肿瘤细胞中受体介导的摄取
作为药物输送系统的高稳定性和有希望的结果
120聚合物纳米结构281纳米,-34.3毫伏顺铂粘膜粘附性
室温稳定性
前4小时内释放30%顺铂并延长释放4天
通过降低顺铂的IC50抑制膀胱肿瘤进展
685.光疗中的纳米平台
红光照射于1975年首次用于杀死肿瘤细胞。从那时起,光动力疗法(PDT)被认为是治疗癌症的一种有前途的策略。121适当的PDT需要三个主要成分,包括光活性药物、适当波长的光和分子氧。121暴露在光线下后,光活性药物会激发到其三重态,与组织中的氧气相互作用,从而导致活性氧(ROS)的产生。PDT被认为是治疗癌症最有前途的方法之一,它具有低副作用并且部分影响邻近细胞和组织。122光热疗法(PTT)也是另一种微创治疗癌症的方法,它使用光热剂将光转化为能量以消除肿瘤细胞。123值得注意的是,PDT和PTT都可以共同利用,以协同方式抑制肿瘤细胞的进展和活力。124,125,126,127本节重点介绍PDT和PTT在膀胱癌治疗中的应用。
目前,由于肿瘤的复发和转移,手术不被认为是治疗膀胱癌的有前途的选择,并且其与化学疗法的结合存在副作用等其他问题。因此,采用PTT等创新方法治疗膀胱癌。Fe(III)掺杂的聚氨基吡咯(FePPy-NH2)纳米结构具有高安全性和高达7.59小时的血液循环半衰期,用于膀胱癌治疗。纳米颗粒优先靶向膀胱肿瘤细胞,积累率为5.07%ID/g。在膀胱肿瘤部位聚集后,采用近红外(NIR)光提供膀胱肿瘤消融,光热转换效率为44%,且无复发。128PTT在膀胱癌消融中的效率取决于合成纳米材料的转化效率。在最近一项关于提高纳米结构用于治疗MIBC的发热能力的研究中,通过引入扭曲的分子内电荷转移(TICT)和分子运动来促进非辐射热的产生。这项工作设计了一种称为2DMTT-BBTD的新型分子,其中四苯乙烯充当分子转子,长烷基链接枝噻吩介导TICT态形成,并在聚集体中保持分子运动,另一方面,吸电子BBTD单元有利于增加TICT效应。2DMTT-BBTD在808nm波长下的近红外辐射吸收能力和PCE值为74.8%。除了2DMTT-BBTD,将藤黄酸(GA)作为热休克蛋白90(HSP90)的抑制剂加载到纳米结构中以防止癌细胞的耐热性。通过用RGD肽进行表面修饰,可以促进纳米结构在肿瘤组织中的积累。这些纳米颗粒可以在MIBC中提供选择性和有效的PTT,同时对邻近组织的影响最小,从而抑制膀胱肿瘤的进展(图3个).129总的来说,用配体(例如磷脂酰丝氨酸)对纳米载体进行表面修饰,可以与膀胱癌细胞表面的受体相互作用,这是增加纳米颗粒在肿瘤部位的积累和增强热疗的有前途的策略。130这种表面修饰及其对内化的影响将在下一节中详细讨论。
图3
(a)注射纳米材料用于PDT和抑制膀胱癌进展。(b)荧光BBTD+GA+IR780/PEG-RGD纳米粒子的示意图和IR780的化学结构。(c)静脉注射BBTD+GA+IR780/PEG-RGD纳米粒子后肿瘤的体内荧光成像。(d)静脉注射BBTD+GA+IR780/PEG-RGD纳米颗粒后肿瘤荧光变化。(e)不同器官和肿瘤的离体荧光图像。F)不同器官的荧光强度。(g)808nm激光照射(0.8Wcm-2,20分钟)后整个小鼠身体的红外热图像。(h)肿瘤温度评估作为808nm激光照射时间的函数。经Zeng等人许可转载。129来自威利
另一项研究报道了用于膀胱癌PTT的含有IR-780的自组装聚合物纳米材料。用透明质酸(HA)修饰纳米结构,以选择性地靶向过表达CD44受体的膀胱肿瘤细胞。纳米颗粒的粒径为171.3nm,并在膀胱肿瘤部位被透明质酸酶降解。这些纳米粒子表现出高光热转换效率,在应用2.5、5、10和20μg/ml的纳米结构后,记录的温度升高分别高达11.2、18.6、26.8和32.3°C。在808nm激光照射下,MB-49细胞的活力降低,体内实验表明纳米结构在膀胱肿瘤组织中积累,并在健康的膀胱壁中部分内化。照射后,肿瘤组织的温度为48度。131虽然大多数实验都集中在膀胱肿瘤中纳米粒子的PTT,但也有研究表明PDT也有利于膀胱癌消融。
光敏剂的静脉内给药已用于治疗膀胱癌,然而,光敏剂的生物利用度差和全身光毒性的可能性导致光敏剂应用的新方法的发展。在这种情况下,一种新颖的创新方法是基于膀胱内滴注的PDT。尽管如此,它也存在一些缺点,包括跨粘膜效率差、缺氧调节不足和安全性低。因此,最近开发了用氟化壳聚糖修饰的人血清白蛋白(HSA)纳米颗粒,用于共同加载作为抗寄生虫剂的硝唑尼特(NTZ)和二氢卟酚36(Ce6),并改善这种跨粘膜屏障的生物相容性。与未修饰的纳米粒子相比,壳聚糖修饰的HSA纳米颗粒表现出更高的细胞摄取和生物相容性。Ce6通过调节膀胱肿瘤细胞的代谢提供PDT和NTZ,并增强PDT以抑制肿瘤。92卟啉是其他可用作光敏剂的试剂,因为它们坚固耐用,具有产生单线态氧的能力,并具有良好的化学、光、热和氧化稳定性。132,133,134,135然而,卟啉在肿瘤部位的不良积累显着降低了它们用作光敏剂的潜力。最近的一项实验合成了杂化纳米载体,该载体由涂有卟啉-壳聚糖的脂质纳米颗粒组成,粒径为130nm,zeta电位为27.1mV。尽管卟啉壳聚糖与脂质纳米载体的结合增加了它们的粒径,但这种结合有利于提高这些载体的稳定性并介导它们的自组装和球形形成。这些纳米结构表现出粘膜粘附特性并增加卟啉的内化,从而导致PDT和膀胱肿瘤抑制。136
这些研究表明,PDT和PTT有利于膀胱癌的治疗。值得注意的是,光疗可以与化学疗法和免疫疗法联合应用,协同抑制膀胱癌。与耐药性相似,肿瘤细胞通过过表达热休克蛋白而具有对PTT的耐药性。最近的一项研究报道了结合PTT、葡萄糖诱导的化学动力学疗法(CDT)和谷胱甘肽(GSH)介导的缺氧缓解的纳米载体。GOx@MBSA-PPy-MnO2纳米结构通过释放Mn2+和增强H2H2的转化表现出高光热转换效率通过类芬顿反应将单线态氧和羟基自由基转化为单线态氧和羟基自由基,以抑制膀胱肿瘤的进展和减少缺氧。值得注意的是,GOx诱导葡萄糖催化以增强用于CDT的H2O2的生成。体外和体内实验表明,这种组合对于预防膀胱癌进展和PTT耐药具有重要意义(图4个).108
图4
(a)制备GOx@MBSA-PPy-MnO2NP的示意图。(b)它们在高效PTT/葡萄糖触发的CDT和GSH触发的膀胱癌缺氧缓解中的应用,(c)肿瘤重量,(d)存活率,(e)HIF-1α的表达水平,和(f)肝功能。经Chen等人许可转载。108来自ACS
膀胱癌治疗领域的重要进展之一是图像引导PTT的发展。这种程序可以了解纳米材料在肿瘤部位的积累和PTT在肿瘤上的定位,以防止对正常和健康组织造成损害。为此,Fe(III)掺杂的聚氨基吡咯(FePPy-NH2)的设计具有高生物相容性和7.59小时的半衰期。值得注意的是,制备的纳米结构在膀胱癌部位表现出高积累(5.07%ID/g)。这些纳米粒子结构中Fe(III)和氨基配位的根本原因是提供磁成像和PTT。纳米粒子的光热转换效率为44.3%,通过诱导PTT,可以消融肿瘤进展,同时提供膀胱肿瘤部位的成像。128
单壁碳纳米管(SWCNT)已用于DOX递送和提供PTT。单壁碳纳米管的载药效率为40%,粒径为220nm。这些纳米结构在肿瘤部位显着积累,通过提供化疗和PTT,它们抑制了膀胱癌的进展。137因此,化疗和光疗的结合在膀胱癌治疗中显示出一些有希望的结果。138这种益处已在体外和体内研究中得到证实。139光疗应用的另一个值得一提的问题是它对免疫系统的影响。据报道,PDT具有ROS过度生成和通过T细胞浸润增强抗肿瘤免疫力的能力。然而,PDT可以增强PD-L1的表达以介导免疫抑制。脂质体用于共同递送二甲双胍和IR-775以增强ROS过度生成并下调PD-L1表达以介导膀胱癌的PDT和免疫治疗(图5个).140因此,另一种方法是结合光疗和免疫疗法来抑制膀胱肿瘤的进展(表2个).从这些讨论中可以得出几个结论,即PDT和PTT在触发膀胱肿瘤细胞死亡方面具有很高的潜力。PDT或PTT与化学疗法和免疫疗法的应用可以导致膀胱癌的协同治疗。此外,使用纳米结构介导的PDT或PTT可以抑制膀胱肿瘤细胞的耐药性。值得注意的是,由于膀胱癌细胞对光疗产生耐药性的能力,建议使用热休克抑制剂。
图5
(a)纳米材料的合成及其在PDT免疫治疗中的应用。(b)荷瘤小鼠在不同时间点静脉注射IR775或IR775@Met@Lip后的实时NIR荧光图像。虚线红色圆圈代表肿瘤。(c)指定治疗后24小时小鼠的离体荧光图像。(d)指定治疗后24小时肿瘤组织和主要器官中IR775荧光信号的定量。经Xiong等人许可转载。140来自ACS
表2用于膀胱癌光疗的纳米结构
纳米载具粒径(nm)、Zeta电位(mV)PTT或PDT评论参考Fe(III)掺杂的聚氨基吡咯纳米颗粒100纳米一键通高生物相容性
血液循环时间7.59h
肿瘤部位蓄积率高
转化效率44.3%,减缓肿瘤进展,预防复发
128GOx@MBSA-PPy-MnO2纳米粒子80.3、94.7和98.3纳米,-11.4毫伏一键通降低增殖率
提供同步化疗和光疗
108Fe3O4@PDA-VCR-FA超粒子128.57和133.87纳米,-35.2毫伏
19.3%
一键通诱导PTT效应
高生物相容性和血液循环时间
肿瘤部位高滞留
141透明质酸-IR780纳米粒子171.3纳米一键通PTT在正常膀胱壁部分蓄积,在膀胱肿瘤组织中优先蓄积
靶向过表达CD44的膀胱癌细胞
131Cu-Fe-Se纳米片70纳米一键通78.9%的高光热转换效率
可用于PTT和化疗的膀胱生物分布
142多反应脂质体230纳米一键通载药效率高,3小时后释放95%DOX
通过与细胞表面的叶酸受体结合增加细胞摄取
同时提供PTT和化疗
49聚多巴胺纳米粒244.2纳米、35.3和31.2毫伏PDT和PTT高胶体稳定性和直到第5天的光敏剂释放
通过内吞作用增加细胞摄取
在膀胱癌抑制中提供PDT和PTT
138Poly(OEGMA)-PTX@Ce6纳米结构168.2纳米太平洋夏令时高细胞摄取和抑制膀胱肿瘤进展高达98%
增加ROS的产生以诱导细胞死亡并降低膀胱肿瘤细胞的活力
细胞凋亡诱导
TGF-β和TNF-α的下调
139在单独的窗口中打开
去:
6.免疫疗法中的纳米平台如前所述,BCG可用作膀胱癌治疗中的免疫治疗剂。然而,卡介苗的应用会引起局部和全身的毒性反应,这些不良反应和刺激性症状促使科学家们将注意力集中在卡介苗的靶向递送上。阳离子壳聚糖纳米颗粒用于BCG的膀胱内递送,它们的粒径为269-375nm,包封效率为42%。纳米粒子的正zeta电位使它们成为BCG膀胱内递送的良好纳米载体。载有卡介苗的壳聚糖纳米结构具有高生物相容性,应用后不会产生全身不良影响。这些纳米结构在膀胱癌组织中积累,显着提高了癌症模型的存活率。150
PD-L1的过度表达有利于膀胱癌的免疫逃逸。作为上游介质,FGFR3通过介导其降解来降低PD-L1的表达水平,从而增加T细胞介导的抗肿瘤免疫,从而减少膀胱肿瘤细胞的进展。151另一方面,CALD1通过JAK/STAT信号诱导提高PD-L1的表达水平,从而介导膀胱癌的免疫逃逸。152因此,免疫逃逸在膀胱癌中是一个复杂的过程,该过程涉及多种机制,其中PD-L1起着核心作用。巨噬细胞衍生的外泌体模拟纳米囊泡(EMV)已被用于递送CD73抑制剂(AB680)和PD-L1抗体。纳米粒子的粒径为218.2nm,zeta电位为-13.7mV。体外和体内实验证明了纳米粒子的高安全性、稳定性和靶向递送至膀胱癌。PD-L1下调阻止了免疫逃逸,CD73抑制剂减少了细胞外腺苷的产生。这种联合作用显着提高了膀胱癌中细胞毒性T淋巴细胞的浸润,以增强肿瘤免疫治疗(图6个).153
图6
(a,b)纳米载体的制备及其抑制膀胱癌进展的作用机制。(c)流式细胞术显示CD8+/CD4+T细胞比率,D)所有组(n=3)免疫刺激后的CD8+/CD4+比率。(e–g)各组肿瘤组织中的TNF-α、IFN-γ和IL-2浓度。经Zhou等人许可转载。153来自ACS
纳米粒子渗透到膀胱癌组织中对于免疫治疗很重要。此外,可以通过递送化学治疗剂和免疫系统相关因素产生协同作用,以提供化学免疫疗法。氟化壳聚糖具有打开膀胱上皮紧密连接的能力,可用于货物输送。氟化壳聚糖可以用PEG和戊二醛修饰以自组装成纳米结构。在膀胱肿瘤部位,纳米结构表面的醛基可以粘附在胶原胺上。然后,氟化壳聚糖打开紧密连接并促进渗透到膀胱肿瘤组织中。吡布星作为化疗剂和IL-12作为免疫刺激剂被加载并导致膀胱癌的化学免疫治疗(体外和体内)。154
图7
膀胱癌中的纳米颗粒和免疫疗法。肿瘤微环境由各种细胞组成,包括肿瘤细胞、T细胞、巨噬细胞、正常细胞和癌细胞。具有高生物相容性的纳米粒子可以在血流中循环到达肿瘤部位。然后,载货纳米粒子可以介导肿瘤微环境重塑并调节与免疫系统相关的分子通路,从而抑制癌细胞的免疫逃逸
去:
7.刺激响应纳米平台近年来,智能和先进的纳米平台在癌症治疗中的应用引起了人们的广泛兴趣。159,160,161,162TME具有几个独特的特性,可用于开发刺激响应性纳米载体。对pH、氧化还原和光的响应是用于设计新型和智能纳米粒子的最常见类型的刺激。pH敏感纳米粒子的功能基于正常细胞和癌细胞pH水平的变化。正常细胞和生理介质中的pH值大于7,而癌细胞的pH值低于6,可根据肿瘤细胞的增殖速度、糖酵解和废物的产生而降低。因此,各种对pH值敏感的键,如腙、缩醛和顺-乙酰基被用于合成和制备pH敏感的纳米载体。pH敏感纳米粒子广泛应用于肿瘤部位的货物(药物或基因)靶向递送,以促进抗癌药物在癌细胞中的积累。氧化还原是智能纳米载体合成的另一种刺激物,暴露于GSH或ROS可导致二硫键断裂并在肿瘤部位释放货物。除了氧化还原和pH值外,正常细胞和癌细胞在氧含量方面也存在差异。健康细胞含氧量正常且含氧量高(70mmHg),而肿瘤细胞含氧量低且含氧量低(5mmHg)。因此,可以使用缺氧作为在肿瘤部位释放货物的刺激物。另一种方法(不太常见但仍然有效)是设计对酶敏感的智能纳米载体。例如,有基质金属蛋白酶(MMP),如MMP-2、MMP-3、MMP-9、MMP-11和MMP-12作为TME中的酶可以切割连接以从纳米载体中释放货物。这些是可用于制备刺激响应性纳米载体的内源性因素。人们也在努力合成对光等外部刺激敏感的智能纳米粒子。将这种纳米载体暴露在光下会导致货物因温度升高而释放。重要的是,通常情况下,癌细胞与可用于合成热敏纳米载体的其他细胞相比具有更高的温度。人们也在努力合成对光等外部刺激敏感的智能纳米粒子。将这种纳米载体暴露在光下会导致货物因温度升高而释放。重要的是,通常情况下,癌细胞与可用于合成热敏纳米载体的其他细胞相比具有更高的温度。人们也在努力合成对光等外部刺激敏感的智能纳米粒子。将这种纳米载体暴露在光下会导致货物因温度升高而释放。重要的是,通常情况下,癌细胞与可用于合成热敏纳米载体的其他细胞相比具有更高的温度。163,164本节重点介绍智能纳米载体在膀胱癌治疗中的应用(图8个)
图8
癌症治疗中刺激响应纳米粒子的示意图。TME的pH低于正常细胞,因此可用于开发pH敏感的纳米载体。此外,GSH的存在会导致键断裂和货物释放;除了pH响应、酶响应和GSH响应的纳米载体外,还可以开发包括光敏和热敏纳米粒子在内的外部刺激响应纳米载体,以提供热疗并诱导膀胱癌细胞凋亡
姜黄素和锌2+已被加工成胶体分散体以制备具有高生物相容性的纳米复合物,通过增强细胞摄取显着增加货物的治疗指数。此外,该纳米复合物提高了姜黄素作为疏水性药物的生物利用度,可用于姜黄素和siRNA的共同递送。纳米复合物呈球形,粒径为80-500nm,表面粗糙,适合附着siRNA。纳米复合物暴露于TME导致姜黄素响应酸性pH释放,这些带正电的纳米载体有效地将siRNA递送至膀胱肿瘤细胞,同时保护其免受酶促降解。除了,165pH敏感脂质体用于治疗膀胱癌。pKa为7.2的mPEG5kDa-DSPE和硬脂酰-PEG-polySDM用于合成脂质体,然后将牛血清白蛋白(BSA)作为蛋白质模型加载到纳米颗粒中。所得纳米载体的粒径为287、235和167,脂质体与MB49细胞和巨噬细胞的相互作用在时比时更高。脂质体响应酸性pH释放蛋白质,它们有效地将货物运送到膀胱上皮细胞,证明了它们在癌症治疗中作为有前途的纳米载体的作用。166大多数实验都集中在膀胱癌治疗中的pH敏感纳米载体上。制备了含有IONPs的多功能纳米粒子,其核心提供磁性,DOX作为抗癌药物,磷酸钙(CaP)作为外壳以介导pH敏感特性。此外,纳米材料被RGD-藻酸盐功能化,以增强它们对膀胱肿瘤细胞的选择性。这些纳米载体表现出高生物相容性,粒径为20nm,并释放货物(DOX)以响应pH值的变化,并显着增强化疗药物在膀胱肿瘤细胞中的内化,从而在协同癌症治疗中提供PTT和化疗。118
此外,氧化还原反应纳米载体被开发用于膀胱癌治疗。多肽纳米凝胶由具有二硫键的PLL-P(LP-co-LC)聚合物制备。10-羟基喜树碱(HCPT)通过轻松扩散载入纳米凝胶的核心,从而实现高载药效率。这些纳米凝胶增加了停留时间并促进了货物渗透到膀胱癌组织中。GSH裂解二硫键的存在与增加货物释放和增强抗膀胱癌增殖活性有关。167另一项实验开发了带正电荷的壳聚糖聚合物纳米颗粒,用于递送藤黄酸作为前药。暴露于ROS和GSH导致药物释放以选择性抑制膀胱肿瘤细胞的进展(图9).168壳聚糖聚合物纳米颗粒通过内吞作用被内化到膀胱癌细胞中,并通过提供刺激反应行为,它们谨慎地聚集在膀胱肿瘤部位(图9).168因此,二硫键导致膀胱癌治疗中氧化还原反应性纳米载体的形成169并抑制进展。170
图9
(a)GSH响应性纳米载体的制备及其在膀胱肿瘤细胞中的内化。(b)体内成像。(c)膀胱区域的时间相关荧光强度。(d)3D荧光分布和(e)DiI或DiI标记的纳米粒子在膀胱尿路上皮横截面中的荧光分布。经Xu等人许可转载。168来自爱思唯尔
综上所述,这些研究表明,pH和氧化还原响应性纳米载体都是很有前途的用于膀胱癌治疗的智能纳米结构。然而,存在一些局限性,包括检查的示例相对较少,需要对其他抗癌药物的递送功效进行更多评估。此外,目前还没有关于外部刺激响应纳米载体应用的报道,这可能是未来研究的重点。刺激响应性纳米载体在体内(动物模型)的强大潜力是它们在膀胱癌部位的高积累。
去:
8.生物传感和生物成像中的纳米平台另一种用于生物传感的纳米平台是磁性纳米粒子。然而,由于蛋白质在其表面的吸附显着降低了它们在生物传感应用中的特异性,因此它们的效率受到限制。通过沉淀反应制备磁性纳米粒子,然后用PEI对其进行修饰,在纳米结构表面提供胺基,从而导致CBMA附着在磁性纳米结构上。所得纳米粒子的表面具有羧酸盐,这对于生物传感的目的很重要。与传统的纳米粒子如PLGA或PEI纳米结构相比,CBMA-PEI磁性纳米粒子在其表面吸收较低水平的蛋白质。核有丝分裂器蛋白1(NuMA1)被用作生物标志物,因为它证明了在尿路上皮癌中的过度表达,并且纳米平台能够检测到膀胱癌细胞表面的这种生物标志物。因此,其在临床试验中的应用应取得更多进展。179
除了检测膀胱癌中的生物标志物外,纳米平台还可用于对这种恶性肿瘤进行成像。尽管MRI、计算机断层扫描和正电子发射断层扫描已被用于膀胱癌的诊断,但绝对需要具有高特异性、分辨率和深层组织穿透力的诊断工具。为此,开发了含有22nm大小的亚铁磁性氧化铁纳米立方体的壳聚糖改性纳米颗粒。用壳聚糖修饰的原因是为了提高MRI对比度,纳米结构表现出高稳定性。这些纳米载体优先积累在膀胱癌组织中,而在其他器官中的生物分布较差,用于肿瘤生物成像。180值得注意的是,纳米结构可用于检测膀胱癌的生物标志物。从未经处理的尿液中,整合素α-3(ITGA3)可以被纳米结构检测到。为此,设计了涂有凝集素的掺铕纳米颗粒,这种基于ITGA3的检测可以区分膀胱癌和BPH。181另一种用于膀胱癌成像的纳米平台是量子点(QD)的应用。182总体而言,量子点由于其体积小和生物相容性高,在癌症成像和治疗诊断方面是很有前途的药物。183由于CD47在膀胱肿瘤细胞表面的过度表达,QD的表面被抗CD47修饰以提供膀胱癌成像。QDs在膀胱肿瘤中积累并显示出高安全性。此外,量子点的膀胱内给药可防止全身给药的副作用。然而,应该对这些纳米材料在临床应用中的长期毒性进行更多研究。182
去:
9.癌细胞内化尽管针对膀胱癌采用了不同种类的治疗方式,但它们在肿瘤部位的低蓄积是一个棘手的问题。例如,合成药物和植物化学物质都广泛用于膀胱癌治疗,它们在肿瘤细胞中的内化率低,限制了它们的治疗指数。核酸药物也存在同样的现象,其在基因表达调控方面的功效受到限制。根据我们之前的讨论,纳米粒子显着增强了膀胱癌细胞对治疗方式的细胞摄取,从而增强了它们的抗癌活性。当前部分显示了纳米载体用于改善膀胱癌治疗方式内化的途径。
细胞表面有特定受体,负责通过称为内吞作用的机制摄取纳米结构。184纳米材料的大小和尺寸相当于细胞内细胞器,它们可能会影响生物过程。由于生物体和纳米粒子之间的相互作用,细胞生理学受到很大影响,这种相互作用可以是积极的也可以是消极的。185改性和未改性的纳米材料都可以通过内吞作用被细胞内化,内吞作用始于膜内陷和细胞内囊泡的产生。186,187胞饮作用和吞噬作用是两种主要的内吞途径,它们的区别在于它们内化的纳米粒子的大小。小尺寸的颗粒通过胞饮作用内化,而尺寸大于500nm的大颗粒通过吞噬作用内化。此外,胞饮作用分为网格蛋白介导的内吞作用、细胞膜穴样内陷介导的内吞作用以及网格蛋白和细胞膜穴样内陷非依赖性内吞作用。188网格蛋白介导的内吞作用和小窝介导的内吞作用途径是能量依赖性的,负责生物分子的细胞摄取。巨胞饮作用独立于网格蛋白介导和细胞膜穴样内陷介导的内吞作用,它们由肌动蛋白丝驱动(图10).189,190
图10
各种内吞途径。巨胞饮作用和胞饮作用是内吞作用的两个主要途径。胞饮作用分为细胞膜穴样内陷和网格蛋白介导的胞饮作用。在这种机制中,纳米粒子与细胞膜结合以内化到细胞中,然后释放它们的货物
纳米粒子的形状、大小和表面电荷是影响膀胱癌细胞内化的因素之一。纳米材料的表面改性会影响它们穿过细胞膜并积聚到膀胱肿瘤细胞中的能力。据报道,来自壳聚糖和HA的杂化纳米材料可用于递送含有HRP和吲哚-3-乙酸(IAA)的酶/前药复合物,以抑制膀胱癌的进展。HA-壳聚糖纳米颗粒的粒径为158nm,由于IAA和HRP的加载,它们的尺寸分别增加到170和200nm。纳米材料的zeta电位在+20.36至+24.40mV范围内,表现出较高的稳定性。它们的封装效率高达90%,并且表现出较高的初始释放(72%)。191虽然混合纳米颗粒在膀胱肿瘤细胞中的内化机制尚未得到评估,但由于HA的修饰,它们可以选择性地结合细胞表面的CD44受体,通过受体介导的内吞作用进行内化。HA和CD44之间的相互作用已在先前的实验中得到证实。192,193,194例如,一项实验制备了含有IONP的膀胱内粘膜粘附水凝胶,用于逆转膀胱癌的耐药性。使用水凝胶的原因是IONPs不能在肿瘤部位充分积累,此外,增加IONPs中的铁水平可通过诱导铁死亡促进其在化学敏感性方面的功效。IONPs用HA修饰,它们通过内吞作用选择性地内化到过度表达CD44受体的膀胱肿瘤细胞中。195作为功能性和非功能性纳米材料都可以利用内吞作用在膀胱肿瘤细胞中内化这一说法的证据,一项研究报告称,载有甲氨蝶呤的磁性纳米结构可能通过受体介导的内吞作用内化。196尽管研究表明纳米粒子有可能通过内吞作用进入膀胱肿瘤细胞,197在未来的研究中应该解决的主要差距和局限性。修饰和未修饰的纳米载体都可以通过胞吞作用内化到膀胱癌细胞中,但是,只有受体介导的内吞作用已经通过研究进行了研究,并且应该对网格蛋白和细胞膜穴样内陷介导的内吞作用进行实验,以将纳米粒子内化到膀胱肿瘤细胞中。此外,内吞作用的评价只是机制上的,但还没有关于纳米粒子的大小、形状和表面电荷对膀胱癌细胞内化的影响的报道,这也应该被考虑在内。最后,这些研究仅限于体外,当纳米材料被引入血液循环时,会在其上形成一种蛋白质冠,这会影响它们在膀胱癌细胞中的命运和内化,
去:
10.临床转化桌子3个总结了纳米结构在临床上用于治疗膀胱癌患者的应用。纳米材料已经进入临床,但仍有一些问题需要解决。临床试验的数量很少,无法提供关于纳米材料的疗效或其在膀胱癌患者中的长期生物相容性的绝对结论。因此,应根据临床前研究得出概率和结论,为即将进行的临床试验提供前景。第一个问题与纳米材料的安全性有关。基于这些实验,包括聚合物、脂质、碳和金属纳米粒子在内的各种纳米材料已被用于膀胱癌的治疗和诊断。然而,聚合物可以降解成单体,未来的研究应该表明这些单体如何影响细胞中的生物事件,是否有任何与它们相关的严重不利影响?此外,金和IONPs等金属纳米粒子可诱导正常细胞死亡,应确定其最佳浓度以用于未来的临床应用。有趣的是,研究表明,用壳聚糖、透明质酸等天然产物对纳米材料进行改性,可以提高纳米材料的生物相容性,前景广阔。研究证实了纳米材料的高稳定性;因此,它们对于通过增加其血液循环时间来提高化学治疗剂的治疗指数具有重要意义。11).
表3使用纳米粒子治疗膀胱癌的临床试验
处理剂阶段地位参考纳米颗粒白蛋白结合紫杉醇加吉西他滨二期终止NCT02887248紫杉醇白蛋白稳定的纳米颗粒制剂二期取消NCT02718742白蛋白结合的雷帕霉素纳米颗粒第一阶段完全的NCT02009332超顺磁性纳米粒子不适用(干预研究)终止NCT00147238在单独的窗口中打开
图11
去:
11.结论和评论TME中的相互作用导致膀胱癌的进展。巨噬细胞是癌症进展的重要和关键参与者,但纳米材料对它们在影响膀胱肿瘤恶性肿瘤方面的调节却被忽视了。此外,与纳米材料介导的免疫疗法诱导相关的研究是有限的,在未来的挑战和希望的实验中应该考虑这些研究。有趣的是,纳米粒子可用于PDT和PTT,在PDT中,它们可提高TME中的ROS水平以诱导细胞死亡。在PTT中,温度升高(体温过高)会刺激细胞死亡。这两种策略不仅降低了膀胱癌细胞的活力,还增加了肿瘤细胞对化学疗法和免疫疗法的敏感性。膀胱癌治疗的进展之一是智能纳米载体的开发。氧化还原和pH敏感纳米粒子可以设计用于通过在肿瘤部位释放货物(基因或药物)来治疗膀胱癌。最后,据报道纳米颗粒通过内吞作用进入膀胱肿瘤细胞。
值得注意的是,纳米结构已被引入临床治疗膀胱癌。然而,其中一些已经被终止,因此,关于它们在临床上的疗效还不能得出绝对的结论。然而,根据临床前研究,将纳米材料引入治疗膀胱癌是一种很有前途的策略,应考虑纳米材料的安全性、可负担性和大规模生产,以实现更广泛的临床应用。
-
戴上“眼镜”就能验毒!禁毒民警现场查毒再添高科技“神器”
2025-10-17 -
龙图光罩:客户入股,订单、估值齐齐暴增,募投项目合理性或存疑|IPO观察
2025-01-09 -
就业直通车 | “赋予植物数字生命”,滴翠智能科技等你来
2025-10-10 -
过压保护是什么意思?怎么构建过压保护电路?一文带你全部搞明白
2025-02-26